
Blog
JULIANA ENRIQUEZ 10C




QUÍMICA


1.

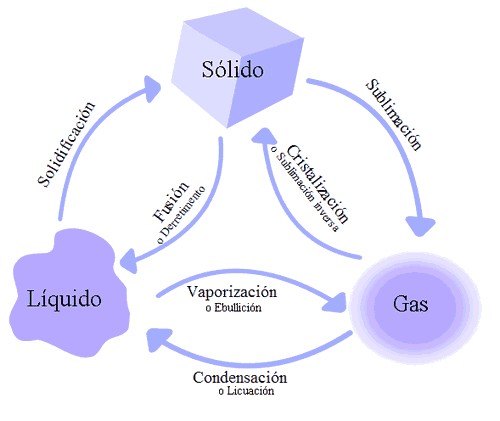
La materia existe en tres estados físicos : sólido, líquido o gaseoso, dependiendo de la temperatura, la presión atmosférica y las características específicas e3l tipo de materia que se trate. Cierto tipo de materia puede existir en los tres estados físicos, como el agua. Otro tipo de materia cuando intenta cambiar su estado físico, se divide en nuevas sustancias, como el azúcar que solo existe en estado sólido.
Existen muhas semejanzas y diferencias entre los tres estados de la materia, y esas son:
La más importante semejanza entre los tres estados de materia es que siempre se conserva la misma composición química. Por ejemplo el agua; tanto líquida, gaseosa o sólida, su fórmula va a ser H2O.
La segunda semejanza es que los tres estados de materia se componen de lo mismo ----> átomos.
La tercera semejanza consiste en que durante los 3 estados de materia se pueden formar enlaces.
La cuarta semejanza es que cualquier estado, puede pasar a otro.
Las diferencias son:
-
Las Densidades : Los gases son de baja densidad, los sólidos de alta densidad y los líquidos de densidad media.
-
Comprensibilidad : Los gases son fácilmente comprensibles y llenan totalmente los recipientes ; esto se debe a la desorganizacioón de sus particulas. Los sólidos en vez, son rigidos y con forma ya determinada, es decir, son dificilmente comprensibles ; esto se debe a que sus particulas estan muy fijas y no tienen espacio para moverse. Finalmente los líquidos, son medio comprensibles debido a que sus particulas no son ni muy rigidas, ni muy desordenadas.
-
La separación molecular: Es mayor en los gases, menor en los sólidos, y media en los líquidos.
-
Movilidad: Como en los gases existen muy pocas fuerzas y atracciones que mantengan a sus moléculas unidas, estos tienen libertad de movimiento. En los sólidos, las moléculas estan fuertemente unidas, por lo tanto es muy poco el movimiento entre ellas. Los líquidos tienen movilidad intermedia.
-
Energía cinética: En los gases es máxima, por ello se mueven fácilmente. Los líquidos son intermedios. Los sólidos tienen muy poca energía cinetica, por ello hay que aplicarles energia en forma de calor para hacer más fácil su movilidad.
-
Forma: En los sólidos es definida, porque las moléculas estan fuertemente atraidas las unas de las otras, y no dejan muchos espacios libres para permitir la movilidad y por ende el cambio de forma. En cambio, tanto en los líquidos como en los gases, la forma es indefinida, por la gran separacioón de sus moléculas y el desorden de las mismas.
-
Volumen: Los sólidos (con poca separación entre moléculas) y los líquidos (con moderada separación entre moléculas) tienen volumenes determinados. En cambio, en los gases, su volumen es indeterminado.
-
Flujo: Los sólidos no fluyen debido a su forma definida. Los líquidos a pesar de tener forma indefinida, sus moleculas son parcialmente ordenadas lo que causa que fluya pero a menor velocidad que los gases. Los gases, al no tener forma y muy poco orden entre sus moléculas fluye a altas velocidades.
2.
Existen muchas aplicaciones del agua como refrigerante.
Naturaleza :
El sudor que producimos es agua que se evapora de nuestra superficie (Piel), al tomar la energía de los vasos sanguíneos en forma de calor. Cuando el sudor toma la energía, esta se le esta quitando al cuerpo, por lo tanto baja la temperatura corporal. Este proceso se llama vasodilatación que ayuda a enfriar nuestro cuerpo. Por otra parte en los días calurosos, las personas pueden aprovecharse de una ducha fría para disminuir la temperatura corporal.
En la naturaleza también se observa el agua como refrigerante en los océanos. Las aguas de los océanos ayudan a enfriar las tierras cercanas, es decir, las costas. Esto lo logra debido a que el agua puede absorber y desprender calor fácilmente, así logra cambiar las temperaturas. La tierra también puede absorver y desprender calor, pero es un proceso mucho más largo.
Industria :
En varias ocasiones se utiliza el agua como refrigerante, por ejemplo en las plantas nucleares para enfriar el nucleo del reactor. Lo que ocurre es que hay una torre de refrigeración en la que se transfieren altas temperaturas para que el agua las absorva y se refrigere el nucleo.
Asi mismo, en muchas habitaciones hoy en día ( Por ejemplo la mayoria de las clases en el CCB), utilizan sistemas de aire acondicionado en los cuales circula el agua fría. Estos se utilizan para enfriar el lugar duarnte días calurosos. Estos trabajan absorbiendo el aire caliente del lugar, enfriandolo con agua a bajas presiones y luego expulsandolo a la habitación.
Finalmente, como los motores de los vehiculos se recalientan demasiado para poder quemar el combustible y hacer el automovil mover, el agua se utiliza para refrigerarlo, y que así no se dañen las conexiones.












3.
Se sabe que las moléculas de agua no son lineales, en vez, son angulares. Esto también provoca que hayan pocos espacios entre moléculas y así adoptando cualquier posición. Por otro lado, cuando el agua se congela, las moléculas adoptan posiciones muy definidas en forma de hexágono, y dejando espacios muchos mayores entre ellas. Esto causa que se disminuya su densidad.
Las consecuencias de esta anomalia es que a una atmósfera de presión (0 ºC) el agua se congela, mientras que el hielo se funde. A esto se le denomina el punto de fusión normal del agua. Esto hace que el agua y el hielo coesxitan a la temperatura de 0 ºC, sin embargo, a temperaturas inferiores el agua se congela, y a temperaturas mayores, el hielo se funde.

4.

Una implicación de la anomalia de que el hielo sea más denso que el agua, es que al tener muchos más espacios, el agua se expande cuando se congela. Por ejemplo un recipiente lleno de agua, al congelarse puede llegar a romperlo. Esto se ve en la vida cotidiana durante las heladas, que causan que el agua utilizada como refrigerante de los motores, se congela y rompa las tuberías.
Otra implicación es que cuando se juntan el agua y el hielo, el hielo flota sobre el agua. Esto se debe a que el hielo tiene menos densidad (0.9168 g / cm3 ) mientras que el agua líquida tiene densidades mayores (0.9971 g / cm3 ).
Una ultima implicación de la anomalía de densidades entre el agua y el hielo, ocurre en los lagos y ríos durante heladas. Cuando la temperatura ambiente alrededor de estos es mucho menor de 0ºC, solo la superficie se congela (los lagos y ríos se van congelando desde la superficie para abajo), dejando por debajo sobrevivir a varias criaturas con temperaturas de 4 o 5 ºC. De esta anomalía, los esquimales construyen sus casas denominadas iglúes.

5.
Análisis Macroscópico:
Lo que ocurre cuando se calienta el agua a 50 °C por encima del punto de ebullición, es que se calienta el vapor de agua. Cuando se esta calentando el agua a 100 °C, esta empieza a burbujear, pero a pesar de que continua el calentamiento, solo se eleva la temperatura hasta que toda el agua haya sido evaporada. Una vez ya ocurra lo anterior, se eleva la temperatura, y ahora lo que se calienta es el vapor de agua.
Análisis Microscópico:
El agua a temperatura ambiente es líquida. Cuando esta se calienta, lo primero que ocurre es que su temperatura aumenta por lo tanto, la movilidad de las moléculas asciende ; debido a que se les esta proporcionando energía cinética en forma de calor. Cuando la temperatura alcanza los 100 °C, se empiezan a formar burbujas ( el agua esta pasando al proceso de ebullición) y así varias se van evaporando, y liberando a la atmósfera en forma de vapor de agua. En este punto, la temperatura se mantiene constante, hasta que toda el agua haya cambiado su estado de materia de líquida a gaseosa. Después, no van a haber cambios físicos si se eleva l temperatura, es decir, el agua a 50 °C por encima de su punto de ebullición normal, es tan solo vapor de agua a 150 °C. Sin embargo, este ascenso se mantiene hasta que se alcanzan los 347 °C ; los cuales son la temperatura crítica del agua.

6.
Las rectas inclinadas de la curva de calentamiento / enfriamiento representan los cambios de temperatura por añadir o disminuir calor. Las lineas planas indican el cambio de un estado de la materia a otro.









punto 2
El pH es una medida de alcalinidad o acidez de una disolución (mezcla de dos sustancias que no reaccionan entre si) que indica el numero de iones hidronio [H3O]+ presentes. Se define por la siguiente ecuación:
La palabra se deriva de la p siendo poder, y H de el conocido elemento Hidrógeno. Juntos significa hidrión exponente iónico. Consiste en que a medida que se liberan más iones de hidrógeno, el valor del pH de la sustancia será menor. Por ello a mayor acidez, menor será el numero del pH.
Este se mide por medio de un potenciómetro también denominado pHmetro. Este funciona midiendo la energía potencial entre dos electrodos a través de una membrana de vidrio. La membrana de visorio separa las dos soluciones con diferente numero de protones. El primer electrodo siendo un electrodo de referencia usualmente cloruro de mercurio y el segundo un electrodo sensible al ion de hidrogeno. Se sumerge un alambre normalmente de plata para conducir la energía hasta un amplificador.
El pH también se puede medir con indicadores, es decir, si la solución es base o ácido representan distintos colores. El indicador más conocido es el papel tornasol.
Todas estas mediciones sirven para compararse con la escala de pH, que va desde 0 a 14 siendo 0 ácido y 14 alcalino. El punto neutro depende de la temperatura, es decir, a 25 °C un pH de 7 es neutro ; menor que 7 es ácido y mayor de 7 es alcalino. Sin embargo a diferentes temperaturas el valor del pH neutro puede variar por la constante de equilibrio del agua.
La escala del pH es logaritmica, es decir los números son separados no por una unidad sino por 10 unidades, desde el numero neutral. Por ejemplo, un pH de 6 es 10 veces más ácido que un pH de 7. O también un pH de 5 es 100 veces más ácido que un pH de 7. Por otro lado un pH de 9 es 100 veces más alcalino que un pH de 7.
La conductividad es la capacidad de transmitir energía en forma de calor, electricidad o sonido. Sus unidades son Siemens por metro (S / m ) y su símbolo es k o s.
La conductividad eléctrica del agua depende del tipo de agua, es decir, que como la conductividad eléctrica se transporta por iones en solución, esta aumenta cuando se aumenta la concentración de iones. Unos ejemplos son :
Conductividad en distintos tipos de aguas:
Agua Ultra Pura 5.5 · 10-6 S/m
Agua potable 0.005 – 0.05 S/m
Agua del mar 5 S/m
La Temperatura es la cantidad de calor que posee un objeto, cuerpo o ambiente. A medida que la temperatura aumente, el pH disminuirá. Esto se da porque las moléculas de agua tienden a descomponerse en sus elementos originarios ( H y O ) al aumentar la temperatura. Por esto se produce más hidrogeno que luego aumenta el pH del agua.
Como se aplican estos conceptos a la calidad del agua ?
El agua potable o agua para consumo humano, es aquella que no presenta ningún riesgo para la salud de la persona. Esta debe tener ciertas características, las cuales son un pH comprendido entre 6.5 y 9.0 según la RESOLUCION 2115 DE 2007 por los ministerios de la Protección Social y de Ambiente, Vivienda y Desarrollo Territorial. También debe oscilar hasta una conductividad de 1000 microsiemens/cm según el Articulo 3o de dicha resolución. Sin embargo, otra resolución indica los parametros de conductividad que debe tener el agua dependiendo de donde se encuentre, dicha tabla se observa más abajo. Finalmente se puede decir que agua con pH 7 solamente se encuentra a 25 °C. Agua a 60 °C tendrá un pH de 6.96.















TRABAJ O de campo


Los datos recibidos de mis compañeros del viaje a la Guajira indican que el agua evaluada si es potable. Esto se puede inferir en las características. Primero, la temperatura oscila entre 24 °C y 29 °C aproximadamente, esto indica que es una temperatura considerable. Por otra parte, la conductividad, tiene un rango entre 4.7 y 100 mV, lo cual indica (tomando los parámetros de la tabla anterior) que se mantiene en el rango de -200 hasta 100 mV, es decir, posee la conductividad de agua perfecta para el consumo humano. Finalmente hay un problema con el pH. Se puede observar en la gráfica que en Playa Camarones, Palomino y Ranchería Vanessa el pH se mantiene entre 6.8 y 7.8, esto quiere decir que posee un pH acorde al agua potable, sin embargo, en la Ranchería Utta, se puede observar que el pH sobrepasa el limite con 9.13. A pesar de que a simple vista no se ve gran alteración debido a que un pH de agua potable debe mantenerse en el rango de 6.5 y 9.0, en mi opinión si es de preocuparse. Mi preocupación se debe a que como investigué anteriormente, la escala de pH es logarítmica, así que cualquier decimal puede significar cantidades mucho mayores.
El agua alcalina o mejor dicho ionizada se debate si es o no beneficiosa para la salud, pero según un estudio publicado en el Revista de Ciencias de Toxicología en 1998, los científicos descubrieron que las ratas que bebían agua alcalina sufrían de enfermedades cardiovasculares, por el endurecimiento de los tejidos del corazón y el descontrolado aumento de peso. También se encontró una mala digestión.
Si lo que referencia los investigadores es cierto, entonces el agua de la ranchería Utta podría causar varias enfermedades, por lo tanto no esta apta para el consumo humano. Sin embargo solo se tomó un dato en cada ranchería, y no se sabe si hubo algún error de medición o de instrumentos, por lo tanto los datos no son suficientes. Lo ideal hubiera sido tomar las características de los distintos lugares en la Guajira, por lo menos 5 veces para así observar cambios y tomar un promedio.
fotos de mis compañeros



reflexion sobre el impacto de la ciencia




bibliografia
Pregunta # 1
Estado de agregación de la materia - Wikipedia, la enciclopedia libre. (n.d.). Retrieved January 28, 2015, from http://es.wikipedia.org/wiki/Estado_de_agregación_de_la_materia
Gonzalez, R. (2009, March 8). Diferencias entre sólidos, líquidos, gases y plasma | Saber Es Práctico. Retrieved from http://www.saberespractico.com/estudios/diferencias-entre-gases-liquidos-y-solidos/
Solano, M. (2007, July 4). Estados de la materia. Retrieved from http://html.rincondelvago.com/estados-de-la-materia.html
Pregunta # 2
Zumdahl, S. S. (2007). Fundamentos de Química (5th ed.). México, ME: Mc Graw Hill.
Pregunta # 3
Meridia, M. (2007, December 15). ¿Por qué el hielo es menos denso que el agua? Retrieved from https://es.answers.yahoo.com/question/index?qid=20070504175447AAXx6We
Zumdahl, S. S. (2007). Fundamentos de Química (5th ed.). México, ME: Mc Graw Hill.
Pregunta # 4
Zumdahl, S. S. (2007). Fundamentos de Química (5th ed.). México, ME: Mc Graw Hill.
Pregunta # 5
Wikipedia, la enciclopedia libre. (n.d.). Retrieved January 28, 2015, from http://es.wikipedia.org/wiki/Agua_sobrecalentada
Zumdahl, S. S. (2007). Fundamentos de Química (5th ed.). México, ME: Mc Graw Hill.
Pregunta # 6
Zumdahl, S. S. (2007). Fundamentos de Química (5th ed.). México, ME: Mc Graw Hill.
Punto 2
Wikipedia. (S.F). Disolución. Recuperado de: http://es.wikipedia.org/wiki/Disolución
Wikipedia. (S.F). pH. Recuperado de: http://es.wikipedia.org/wiki/PH
Nutrivea. (S.F). La escala del pH. Recuperado de: http://www.nutrivea-es.com/la_escala_del_ph.htm
Conductividad del agua (- Lenntech)
http://www.lenntech.es/aplicaciones/ultrapura/conductividad/conductividad-agua.htm
Wikipedia. (S.F). Agua Potable. Recuperado de : http://es.wikipedia.org/wiki/Agua_potable
Ministerio de Protección Social., & Ministerio de Ambiente, Vivienda y Desarrollo Territorial. (2007, June 22). RESOLUCION 2115 DE 2007. Retrieved from http://www.sui.gov.co/suibase/formatosEstratificacion/normatividad/Res.%202115%20de%202007.pdf
Reflexión
¿Quién se robó el agua de La Guajira? (2014, September 4). Retrieved February 7, 2015, from http://www.semana.com/nacion/articulo/quien-se-robo-el-agua-de-la-guajira/398006-3
Arévalo, H. (2014, August 13). "Gobierno impide envío de agua y donaciones a La Guajira" Retrieved February 7, 2015, from http://www.las2orillas.co/gobierno-impide-envio-de-agua-y-donaciones-a-la-guajira/
Urrea, D., & Calvo, I. (2014, August 6). Conflictos socio - ambientales por el agua en La Guajira. Retrieved February 7, 2015, from http://censat.org/es/analisis/acciones-sociales-frente-a-conflictos-ambientales-conflictos-socio-ambientales-por-el-agua-en-la-guajira
Científicos buscan producir plantas tolerantes a la sequía - Universidad de Talca. (2013, January 11). Retrieved February 7, 2015, from http://www.utalca.cl/link.cgi//SalaPrensa/Investigacion/5639
Perforadoras para pozos agua. (2014, January 1). Retrieved February 7, 2015, from http://www.tecnologiaminera.com/tm/d/novedad.php?id=213
Desalinización. (2013, May 14). Retrieved February 7, 2015, from http://es.wikipedia.org/wiki/Desalinización#Desalinizaci.C3.B3n_por_.C3.B3smosis_inversa_.28oi.29
PARÁMETROS DE CALIDAD Y LÍMITES MÁXIMO PERMISIBLES. (2014, June 6). Retrieved February 7, 2015, from http://www.sunass.gob.pe/doc/normas legales/legisla web(cambio)/normas/calidad de agua/Oficio 677.pdf